新闻中心
近日,中国农业科学院哈尔滨兽医研究所王晓钧团队在《PLoS Pathogens》杂志刊载了题为 「Selective usage of ANP32 proteins by influenza B virus polymerase: Implications in determination of host range」的文章。该文章系统性地揭示了 B 型流感病毒感染的种间限制机制,发现宿主 ANP32A&B 蛋白是决定 B 型流感病毒聚合酶活性的须关键因子。

甲型流感病毒(IAV)和乙型流感病毒(IBV)属于正粘病毒科。禽类作为 IAV 的重要宿主,经常将 IAV 跨物种传播给哺乳动物。而 IBV 与 IAV 复制机制类似且受体相同,却少有禽类自然感染 IBV 的报道,这说明 IBV 在禽类体内无法复制,但具体机制尚不明确。
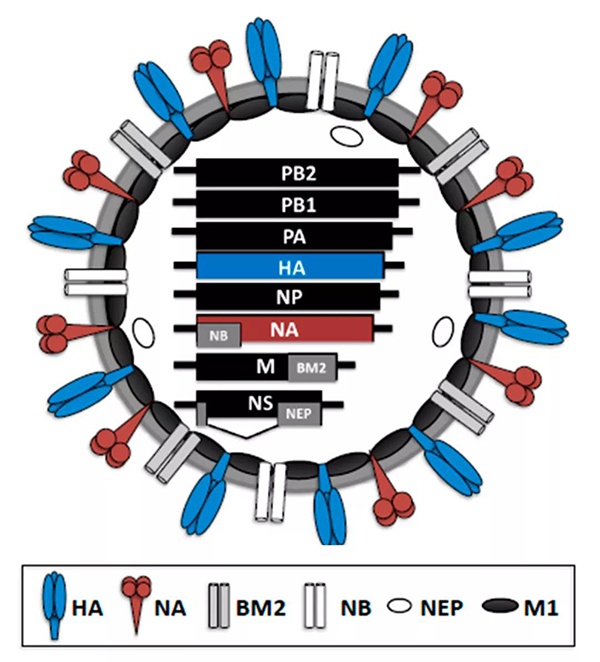
图 2 乙型流感病毒结构示意图
前期研究已经证明,宿主 ANP32A&B 蛋白在 IAV 聚合酶活性中起到关键性作用,那么 ANP32 蛋白是否在 IBV 的复制中也具有类似的功能呢?不同物种的 ANP32 蛋白是否为 IBV 提供不同的支持?
研究团队构建出不同的细胞系,利用聚合酶双荧光报告系统等技术,获得重大发现,其中两点尤为突出:
1.ANP32A、ANP32B 对于 IBV 的复制起主要作用,ANP32E 的作用相对有限;
2.哺乳动物 ANP32A&B 蛋白可以完全支持 IBV 聚合酶复制,而禽类 ANP32A 由于有 33 个氨基酸的插入以及禽类 ANP32B 由于 129/130 位点的突变,导致禽类 ANP32A&B 均无法支持 IBV 的复制。
为进一步探索不同物种 ANP32 蛋白支持 IBV 聚合酶活性差异的分子机制,该研究利用 Co-IP,以及基于 Biacore 的表面等离子共振 SPR 等技术进行相关检测。
Co-IP 实验结果显示: huANP32A 和 chANP32A 对于 IBV 聚合酶具有相似的结合能力,但无法给出定量的结合差异分析。为了解决这个问题,研究人员使用 Biacore 对 IBV 聚合酶与 ANP32 蛋白进行动力学/亲和力表征。

研究人员使用 CM5 芯片氨基偶联 Anti-His 抗体自制 Anti-His 捕获芯片,随后流经含有 His-IBV 聚合酶的细胞裂解液,捕获 His-IBV 聚合酶。然后将 ANP32 蛋白稀释到一系列浓度作为流动相,使用 Biacore T200 对聚合酶与 ANP32 蛋白进行动力学/亲和力表征。
实验结果表明:与 Co-IP 结果一致,huANP32A,chANP32A 和 huANP32A + 33 在 0.15625-5μM 的浓度下均能与病毒聚合酶结合(图 4A – 4C)。相反,huANP32A_165T 几乎不与聚合酶结合(图 4D)。在另一个仅将两个聚合酶亚基(PA 和 PB1)固定在 CM5 芯片上的对照实验中,在 huANP32A 和病毒聚合酶亚基之间未检测到特异性亲和力(图 4E)。
通过 Biacore 分析计算得出 huANP32A,chANP32A 和 huANP32A+ 33 的解离平衡常数(KD)有着显著差异。huANP32A 与 IBV 聚合酶结合,KD = 0.05418μM,几乎比 chANP32A 低 3 倍。插入 33 个氨基酸的 huANP32A 和聚合酶结合的 KD 值也从 0.05418μM 增加到 0.1013μM(图 4F)。尽管 huANP32A,chANP32A 和 huANP32A + 33 具有相似的解离速率常数(kd),但结合速率常数(ka)却截然不同。huANP32A 与 His-IBV 聚合酶结合的 ka 值是其他两种蛋白质的 ka 值的两倍。
该结果表明,与 ChANP32A 相比,huANP32A 对 IBV 聚合酶具有更强的结合亲和力,并且 33 个氨基酸的插入降低了 ANP32A 与 IBV 聚合酶的结合亲和力。
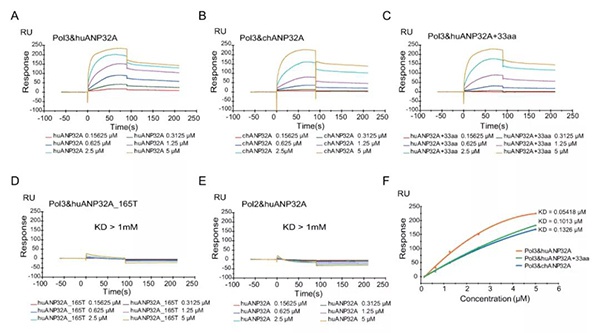
图 4 IVB 聚合酶与 ANP32 蛋白互作 Biacore 结果
该研究揭示了哺乳动物 ANP32 家族蛋白是支持 IBV 复制的关键宿主蛋白,并明确了禽类 ANP32 蛋白无法支持病毒聚合酶活性的分子机制(图 5)。对理解 IBV 聚合酶功能、作用机理和宿主范围决定因素具有重要意义,同时可为抗 IBV 药物靶点设计和跨物种传播的防控提供理论依据。
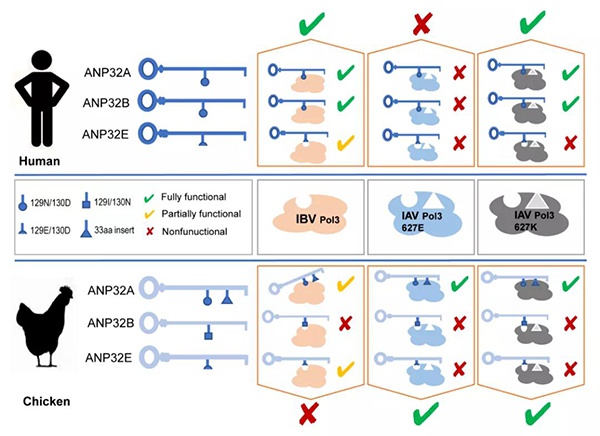
图 5 IAV 和 IBV 聚合酶对 ANP32 蛋白的选择性使用及其分子基础
纵观全文,Biacore 的技术优势清晰易见
1、Biacore 区分出不同物种、不同氨基酸结构的同源蛋白与 IBV 聚合酶相互作用的细微差异,这是 Co-IP 等同类技术所不具备的,充分体现出 Biacore的分辨率。
2、Biacore 互作信息,帮助研究人员从 KD、ka、kd 等方向表征分子相互作用,定量地阐释不同分子之间相互作用的异同点,从而帮助科研人员好的阐明相关的分子机制。
3、利用 Biacore 可以直接捕获粗样品中的目的蛋白,并进行亲和力动力学的表征。这这篇文章中,研究人员利用 Anti-His 捕获芯片,能够从细胞裂解液中直接捕获 His-IBV 聚合酶,并检测其与 ANP32 蛋白的互作。这样只需要纯化一种蛋白即可进行的亲和力动力学表征,降低了样品准备时间与难度。
自 1990 年上市自今,Biacore 经过 30 年的发展,已经成为分子互作检测的「金标准」,广泛应用到基础科研与药物开发的多个领域,累计发表的文章已经过四万篇,过 80% 的上市抗体药物在研发、申报与生产中都使用了 Biacore。
